Accueil > Équipes scientifiques > Nanomédecine et Biophotonique (NanoBio) > Imagerie de fluorescence à l’échelle nanoscopique pour la biologie > Microscopies au delà de la limite de diffraction > copie
copie
Nous développons de nouveaux instruments permettant de dépasser la limite de diffraction par une ingénierie des transitions des fluorophores ou de leur émission. Trois nouveaux microscopes sont en cours de développement afin d’atteindre des résolutions latérales ou axiales ultimes. Le microscope de fluorescence supercritique (SAF) permet d’améliorer la résolution axiale et d’observer simultanément les événements sous les 150 premiers nanomètres et à l’intérieur de la cellule en introduisant une sélectivité de l’émission des fluorophores. Le microscope sous émission stimulée (STED) permet d’atteindre une résolution latérale de 40 nm par déplétion sélective des fluorophores localisés à la périphérie de la zone de focalisation, induisant un volume d’étude intrinsèquement réduit. Le microscope de super-localisation (dSTORM) permet de découpler la détection des fluorophores situés dans une même fonction réponse, en induisant leur fluorescence de façon stochastique afin de pouvoir localiser individuellement et de façon successive les molécules émettrices.
-Supercritical Angle Fluorescence Microscopy - SAF
Stimulated emission depletion microscopy -STED
La microscopie STED (Stimulated Emission Depletion), permet en désexcitant sélectivement les fluorophores à la périphérie du point focal (cf. fig), de réduire considérablement la zone émettant de la fluorescence, et ainsi de bénéficier d’une résolution d’une dizaine de nanomètres. Cette technique mise au point par l’équipe de Stefan Hell n’est pour l instant que peu développée, car potentiellement lourde à mettre en œuvre.
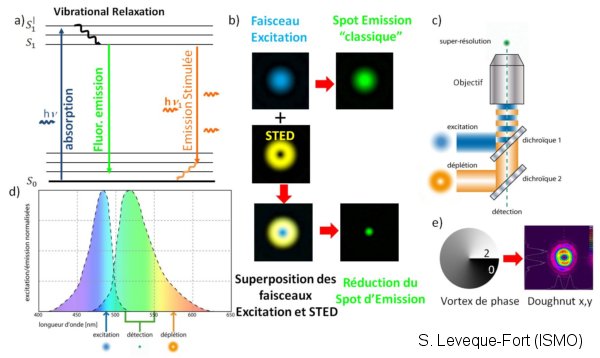 En collaboration avec le groupe ELSA de l’institut d’optique et le CPBM, nous avons mis au point, un système offrant l’accordabilité dans le visible pour l’excitation et le faisceau STED, associée à une détection dynamique (FLIM/FCS). Basé sur un laser à continuum générant les 2 faisceaux, STED et excitateur, de cadence variable autour de quelques MHz, ce dispositif permet d’obtenir une résolution de 40 nm avec une approche technologique simplifiée.
En collaboration avec le groupe ELSA de l’institut d’optique et le CPBM, nous avons mis au point, un système offrant l’accordabilité dans le visible pour l’excitation et le faisceau STED, associée à une détection dynamique (FLIM/FCS). Basé sur un laser à continuum générant les 2 faisceaux, STED et excitateur, de cadence variable autour de quelques MHz, ce dispositif permet d’obtenir une résolution de 40 nm avec une approche technologique simplifiée.
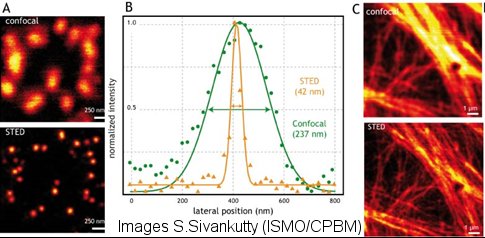
Notre dispositif réalisé dans le cadre de la thèse de Siddharth Sivankutty permet actuellement d’atteindre une résolution latérale d’environ 40 nm, comme illustrée sur des images de nanosphères fluorescentes et le profil associé ( cf fig). Les expériences sur le marquage du réseau d’actine permettent de mettre en évidence que le gain en résolution est conservé en milieu cellulaire
direct stochastic optical reconstruction microscopy - dSTORM/PALM
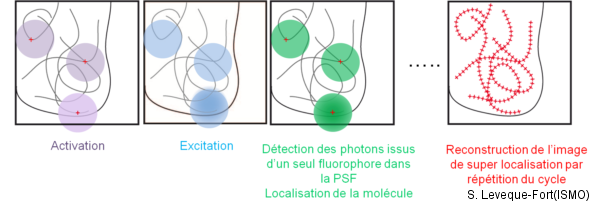
La microscopie par super-localisation permet d’atteindre une résolutions latérale de l’ordre de 20 nm, grâce à la possibilité d’acquérir à des instants différents l’émission des fluorophores qui se situent dans la fonction réponse du microscope (PSF). Différents acronymes décrivent ces approches de super-localisation par exemple le dSTORM (direct STochastic Optical Reconstruction Microscopy) lorsqu’on utilise des fluorophores organiques ou le PALM lorsqu’on utilise des protéines fluorescentes photoactivables (Photo-Activation Localization Microscopy). L’idée générale dans les deux cas est de n’autoriser dans la PSF qu’une infime partie des fluorophores à être dans un état pouvant conduire à l’émission de fluorescence. Dans le cas du PALM, l’expérimentateur contrôle l’activation stochastique, la lecture, puis la désactivation des protéines fluorescentes. Au début de l’expérience, les sondes photo-activables présentes dans l’échantillon sont dans l’état « OFF » : elles ne produisent aucun signal de fluorescence. La première étape consiste alors à faire passer une très petite fraction (moins de 1‰) des sondes dans l’état « ON » (photo-activation liée par exemple à un changement de conformation) grâce à un pulse de lumière de courte longueur d’onde (typiquement 405 nm pour la protéine Eos). On réalise ensuite une image en fluorescence des sondes activées avec une source appropriée (typiquement 561 nm pour la protéine Eos). Chaque sonde activée produit une tache image de fluorescence dont la taille est donnée par la limite de diffraction. En revanche, le barycentre de cette tache peut être localisé avec une précision bien supérieure à la limite de diffraction de l’ordre de quelques nanomètres. Une fois que ces sondes activées ont été précisément localisées, elles sont éliminées par photoblanchiment. Une seconde fraction des sondes est ensuite activée, lue, localisée puis éliminée, ce cycle est répété plusieurs milliers de fois de façon à accéder à la localisation de la quasi-totalité des sondes présentes (cf. fig.) . L’image PALM est en fait l’image composite obtenue en sommant les contributions des localisations nanométriques obtenues lors de chaque cycle.
Dans le cas des images dSTORM, il s’agit initialement de mettre un maximum de fluorophores (type Alexa) dans un état non fluorescent, et de bénéficier du retour stochastique dans l’état fondamental permettant ensuite une observation de la fluorescence.
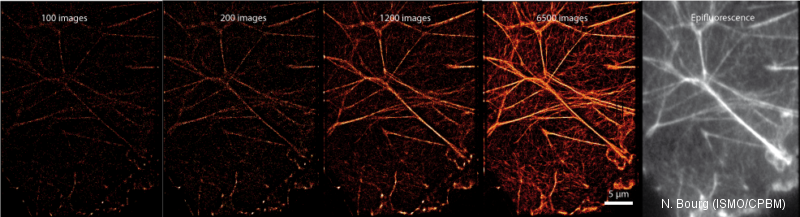
 . Le dispositif réalisé dans le cadre de la thèse de Nicolas Bourg nous permet de réaliser des images multicouleurs avec de l alexa 488,561 ou 640.
. Le dispositif réalisé dans le cadre de la thèse de Nicolas Bourg nous permet de réaliser des images multicouleurs avec de l alexa 488,561 ou 640.
Un exemple d’image est représenté ci dessous, on voit ainsi qu’en fonction du nombre d’images acquises, la précision de localisation liée au nombre de photons détectés augmente. On peut voir sur l’image finale (6500 acquisitions) que le sous réseau d’actine est ainsi extrêmement bien visible sur l’image dSTORM, alors qu il est flou en épifluorescence.