Equipe CHIralité et spectroscoPIE (ChiPie)
Anne Zehnacker-Rentien (DR CNRS), Katia Le Barbu-Debus (CR CNRS) et Valéria Lepère (MCF Univ Paris Saclay)
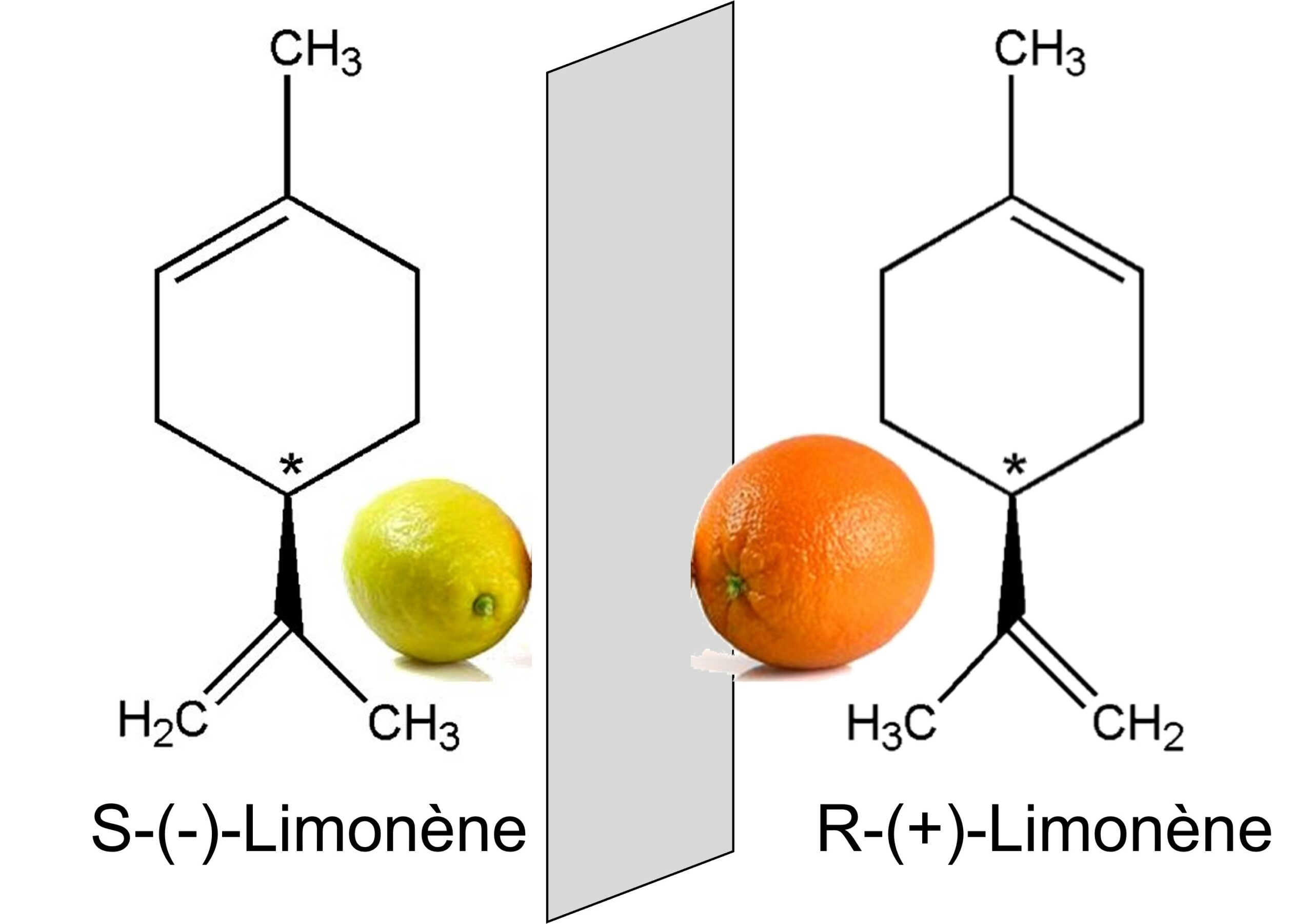
La chiralité est une caractéristique importante du vivant, c’est la propriété d’une molécule de ne pas être superposable à son image dans un miroir, comme la main droite n’est pas superposable à la gauche.
C’est le cas de la plupart des acides aminés, de l’ADN… Les deux images dans un miroir sont appelés « énantiomères ». Les deux énantiomères ont les mêmes propriétés physico-chimique lorsqu’ils sont dans un environnement achiral mais acquièrent des propriétés différentes dans un milieu chiral. Les médicaments chiraux, par exemple, ont souvent une activité thérapeutique énantiosélective, parce que leurs récepteurs dans le corps sont eux même chiraux.
C’est pourquoi il est important de distinguer les deux énantiomères d’une molécule chirale. Ceci est possible en utilisant une sonde qui est elle-même chirale, et qui peut être soit de nature chimique (une autre molécule chirale) soit de nature physique (une onde polarisée circulairement). Nos études s’orientent selon ces deux axes, vers différentes techniques de dichroïsme circulaire, et vers l’étude spectroscopique de systèmes comportant plusieurs centres chiraux qui peuvent être de chiralité identique ou opposée.
Etudes actuelles
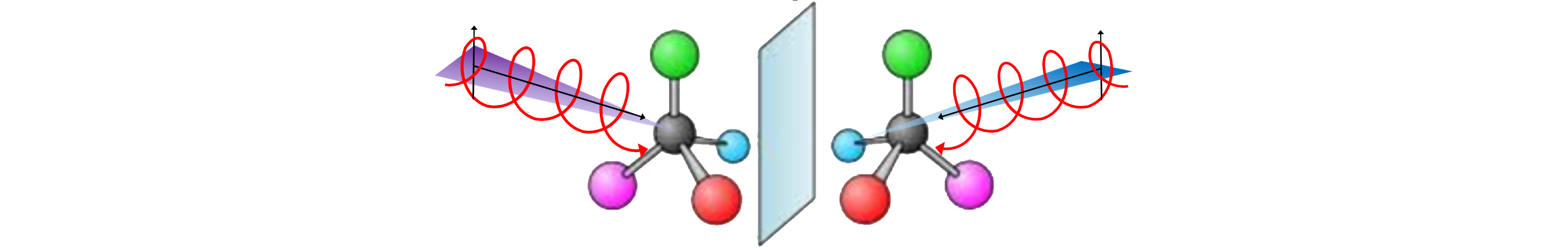
Le dichroïsme circulaire de photoélectron (PECD) consiste à observer une asymétrie avant / arrière dans la distribution angulaire des électrons émis lors de la photoionisation d’une espèce chirale (condition obligatoire) par de la lumière polarisée circulairement (CPL). L’effet mesuré peut atteindre 40%. Nous avons montré récemment que le PECD, comme d’autres méthodes de dichroïsme circulaire, a une très forte sensibilité à la conformation moléculaire. Nous avons développé une méthode de PECD par laser qui fournit simultanément des informations sur la chiralité et le paysage conformationnel des systèmes chiraux.
Ces travaux sont menés en collaboration avec L. Nahon et G. Garcia de la ligne VUV DESIRS au synchrotron SOLEIL.
Transfert de chiralité
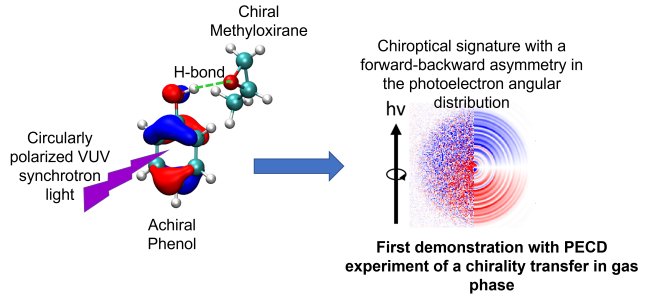
Un exemple est donnée ci-dessous avec l’apparition d’une asymétrie dans l’éjection du photoélectron issu de l’ionisation d’un chromophore non-chiral (phénol) complexé avec une molécule chirale (méthyloxirane). Dans cette situation, un transfert de chiralité est observée en phase gazeuse pour la première fois.
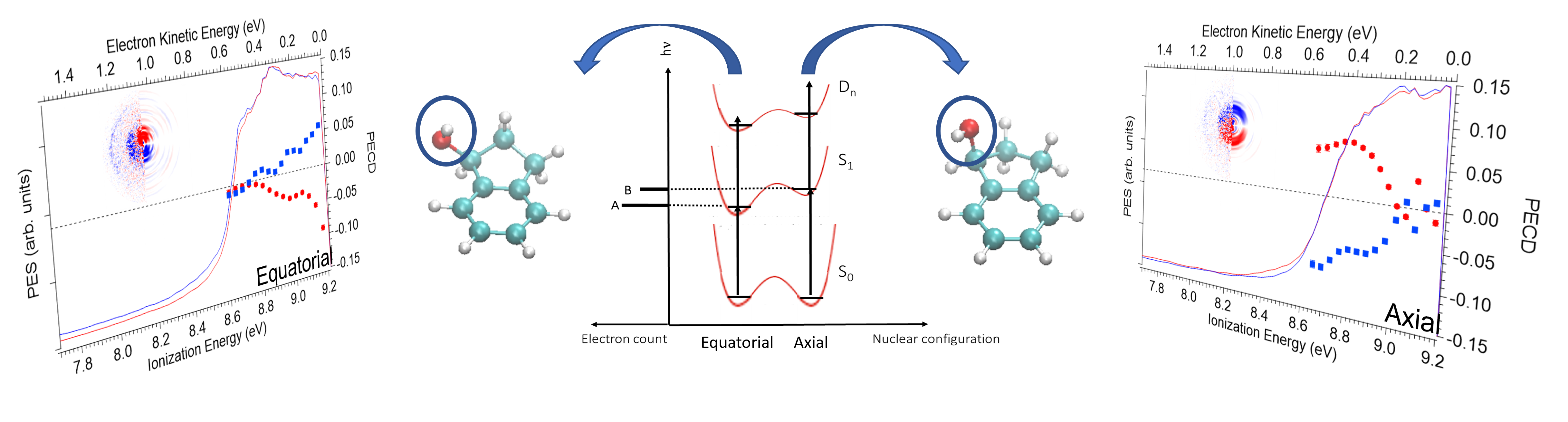
PECD résolu en conformère
La nouvelle expérience développée récemment a permis de sonder le PECD de chaque conformère de l’1-indanol séparément. Chaque conformère, appelé eq ou ax, ont des asymétries de PECD de signe et de norme très différents, montrant l’importance de telles mesures.
Publications
- Induced photoelectron circular dichroism onto an achiral chromophore
Rouquet, M. Roy Chowdhury, G. A. Garcia, L. Nahon, J. Dupont, V. Lepère, K. Le Barbu-Debus & A. Zehnacker – Nature Communication 14, 6290 (2023) - Conformer-Selective Photoelectron Circular Dichroism
Rouquet, J. Dupont, V. Lepere, G. A. Garcia, L. Nahon, A. Zehnacker – Angewandte Chemie-International Edition 2024, e202401423
Le dichroïsme circulaire vibrationnel (VCD) est la très faible différence d’absorption entre la lumière polarisée circulaire droite et gauche par une molécule chirale, dans le domaine des transitions vibrationnelles. Outre son utilisation pour la détermination des configurations absolues, le VCD est extrêmement sensible à l’isomérie conformationnelle, aux interactions moléculaires, à la solvatation, et à la structure cristalline. Nous utilisons le VCD pour sonder ces effets.
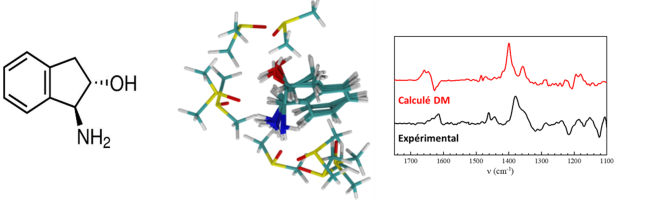
Description de la solvatation dans des molécules flexibles
Les dérivés de l’indane sont des molécules chirales flexibles montrant un mouvement d’inversion de cycle. Dans ces systèmes, l’interaction soluté-solvant est correctement représentée par un agrégat de taille fini dans un continuum de solvant. Toutefois, une vision gelée du solvant est restrictive et une approche par dynamique moléculaire rend mieux compte de l’influence de la fluxionalité du solvant sur le spectre VCD.
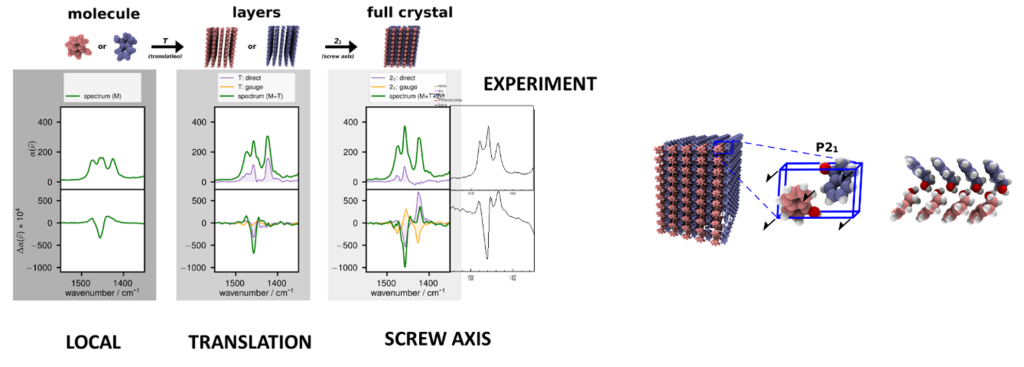
Structure des solides
La sensibilité de la VCD aux facteurs structuraux en fait une bonne sonde de la structure cristalline, en particulier des co-cristaux et du polymorphisme qui jouent un rôle majeur en sciences pharmaceutiques. L’interprétation des spectres VCD de solide cristallins exige de prendre en compte les effets non-locaux, c’est-à-dire non localisés sur une seule molécule, dont la contribution est influencée par la symétrie du cristal.
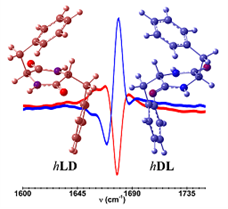
Cyclisation de dipeptides
Une application du VCD est le suivi de la synthèse en phase solide de la cyclo LD‑di‑phénylalanine par cyclisation thermique intramoléculaire de la di-phénylalanine. On observe la formation d’une phase cristalline chirale résultant de la synchronisation de la chiralité transitoire de ses sous unités.
Collaborations
Ces études entre dans le cadre des projet ANR Dichroprobe (2018-2023) et Dichrosol (2023-2027), en collaboration avec Carine Clavaguera (LCP Orsay), Rodolphe Vuilleumier (Laboratoire PASTEUR ENS Paris), Florent Calvo (IPG Grenoble)
Publications
- Solid-state synthesis of cyclo LD-diphenylalanine: A chiral phase built from achiral subunits
Perez-Mellor, K. Le Barbu-Debus, and A. Zehnacker – Chirality, 2020, 1-12 - Assessing cluster models of solvation for the description of vibrational circular dichroism spectra: synergy between static and dynamic approaches
Le Barbu-Debus, K.; Bowles, J.; Jähnigen, S.; Clavaguéra, C.; Calvo, F.; Vuilleumier, R.; Zehnacker, A. – Physical Chemistry Chemical Physics 2020, 22 (45), 26047-26068 - How Crystal Symmetry Dictates Non-Local Vibrational Circular Dichroism in the Solid State
Jahnigen, S.; Le Barbu-Debus, K.; Guillot, R.; Vuilleumier, R.; Zehnacker, A. – Angewandte Chemie-International Edition 2022, e20221559
Les dipeptides cycliques comportant deux résidus R1 et R2 ont des propriétés qui dépendent de la configuration absolue de leurs résidus, identique ou opposée, et notée LL ou LD.
Effet de la chiralité sur la structure : cyclo-Tyr-Tyr neutre en jet supersonique.
La géométrie de cyclo-L-Tyr-D-Tyr est dissymétrique, avec un chromophore tyrosine étendu vers l’extérieur, l’autre étant replié sur le cycle peptidique. Ce type de conformation existe aussi pour cyclo-LTyr-LTyr mais ce dernier possède un deuxième conformère. Celui-ci a un spectre IR caractéristique d’une liaison hydrogène entre les deux OH, qui force les deux cycles aromatiques à adopter une géométrie en « sandwich ».

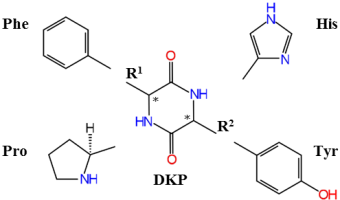
Effet sur la désactivation des états excités : complexes de cyclo Tyr-Tyr avec des métaux.
Les complexes de métaux alcalins du dipeptide cyclique cyclo-Tyr-Tyr ont été étudiés dans des conditions de piège à ions cryogéniques par photodissociation dans l’infrarouge (IRPD, spectroscopie vibrationnelle et UV (UVPD, spectroscopie électronique) et des calculs de chimie quantique (Collaboration M. Fujii S. Ishiuchi, Tokyo Institute of Technology)
Pour des résidus de chiralité identique, le cation interagit avec le groupe carbonyle CO d’une fonction amide et un seul des cycles aromatiques, qui est en géométrie étendue. Le dipeptide garde une conformation « étendue-repliée » quel que soit le métal.
Pour les résidus de chiralité opposée, le cation métallique est situé entre les deux cycles aromatiques. Il interagit donc avec les deux nuages d’électrons p et la distance entre les deux cycles dépend fortement du métal.
Les processus de désactivation de l’état excité dépendent à la fois de la chiralité des résidus et de la nature de l’ion métallique. Cyclo-LTyr-L-Tyr-Na+ se distingue par la présence d’états de transfert de charge de basse énergie, ce qui entraîne un élargissement du spectre électronique et une augmentation du taux de fragmentation.
Effet de la chiralité sur la fragmentation : spectrométrie de masse de cyclo-His-Phe protoné.
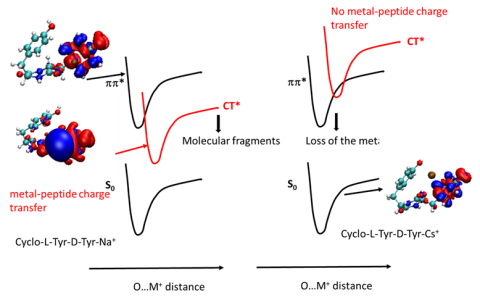
Pour tous les dipeptides étudiés, le site de protonation est le CO du cycle peptidique, sauf pour le cyclo-His-Phe pour lequel c’est l’imidazole. Ceci influence fortement les mécanismes de fragmentation et leur sensibilité à la chiralité. Des calculs de dynamique moléculaire réalisés en partant de la structure définie par spectroscopie vibrationnelle interprètent les mécanismes de fragmentation dans le cadre du modèle du proton mobile. (Collaboration avec R. Spezia, Laboratoire de Chimie Théorique Sorbonne Université).
Le mécanisme décrivant la perte de NH3 fait intervenir des états intermédiaires dans lesquels l’ouverture du cycle peptidique entraîne la disparition d’un des centres stéréogènes (carbone asymétrique). La barrière à la formation de cet intermédiaire est donc identique pour cyclo-LHis-LPheH+ et cyclo-LHis-DPheH+, ce qui rend la réaction insensible à la chiralité.
Le mécanisme décrivant la perte de CO implique des états intermédiaires conservant le cycle peptidique intact avec ses deux centres stéréogènes. Il nécessite une migration du proton de l’imidazole vers le cycle peptidique, qui se produit avant l’ouverture du cycle. Il faut donc franchir une barrière due à la rotation du substituant imidazole, qui est différent pour cyclo-LHis-LPheH+ et cyclo-LHis-DPheH+. Ce mécanisme explique la stéréosélectivité de la perte de CO qui est plus grande dans cyclo-LHis-DPheH+.
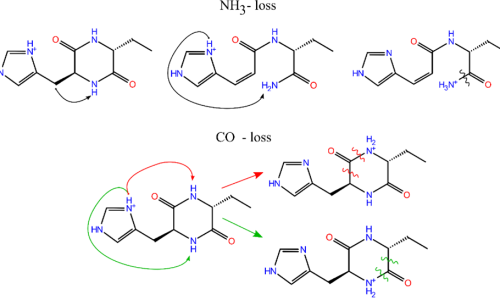
Effet de la chiralité sur l’agrégation : dimère de cyclo-His-Phe protoné.
On observe des différences importantes dans le spectre vibrationnel des dimère protonés (cyclo-LHis-LPhe)2H+ et (cyclo-DHis-LPhe)2H+, dues à des structures très différentes. En effet la formation d’un dimère de type « feuillet β », avec une double liaison hydrogène NH…O=C, n’est possible que pour le diastéréomère LL. Un changement de chiralité empêche donc la formation de dimères de type amyloïde.
Publications
- Stereochemistry-dependent hydrogen bonds stabilise stacked conformations in jet-cooled cyclic dipeptides: (LD) vs. (LL) cyclo tyrosine-tyrosine.
BenNasr, F.; Pérez-Mellor, A.; Alata, I.; Lepere, V.; Jaidane, N. E.; Zehnacker, A. Faraday Discussions 2018, 212, 399-419. - Structure and collision-induced dissociation of the protonated cyclo His-Phe dipeptide: mechanistic studies and stereochemical effects.
Pérez-Mellor, A.; Le Barbu-Debus, K.; Lepere, V.; Alata, I.; Spezia, R.; Zehnacker, A. The European Physical Journal D 2021, 75 (6), 165. - Does Chiral Sensitivity of a Structure Depend on the Metal Core? Alkali Ion Complexes of Cyclo(Tyr-Tyr).
Yoshizawa, K.; Hirata, K.; Ishiuchi, S.-i.; Fujii, M.; Zehnacker, A. ChemPhysChem 2023, 24 (18). - How change in chirality prevents beta-amyloid type interaction in a protonated cyclic dipeptide dimer.
Le Barbu-Debus, K.; Perez-Mellor, A.; Lepere, V.; Zehnacker, A. Physical Chemistry Chemical Physics 2022, 24 (33), 19783-19791.
Reconnaissance chirale en phase gazeuse
La reconnaissance chirale, telle qu’elle est observée dans l’activité de certains médicaments dont un énantiomère interagit plus favorablement que l’autre avec sa cible biologique, repose sur la formation de paires de contact transitoires impliquant des interactions stéréospécifiques.
Le principe de nos études est de stabiliser des complexes faiblement liés formés en phase gazeuse entre deux molécules chirales, et à étudier leur structure. Les expériences reposent sur l’utilisation d’un jet supersonique, qui permet de refroidir les molécules à quelques K et de stabiliser des complexes faiblement liés qui seraient détruits par l’agitation thermique à température ambiante. Les méthodes de spectroscopie laser utilisées ont la particularité d’être résolue en conformation : on obtient séparément les spectres vibrationnels de chaque conformère des complexes diastéréomères, qu’on interprète par des calculs de chimie quantique. La comparaison des structures des complexes homochiral et hétérochiral permet de comprendre la nature des forces responsables de la reconnaissance chirale.
Ces études ont par ailleurs montré que la formation des complexes en jet supersonique est sous contrôle cinétique : on n’observe pas toujours le complexe le plus stable, mais celui dont la formation ne nécessite pas de franchir une barrière énergétique liée à la modification de la structure des monomères lors de la formation du complexe (énergie de déformation)
Dimérisation des diols :
Nous avons étudié les dimères homo- et hétérochiraux d’un dérivé chiral du cis-1,2-cyclohexanediol, le 1-phényl-cis-1,2-cyclohexanediol (cis-PCD). La préférence homochirale observée dans la formation du dimère se reflète dans la formation d’un conglomérat à l’état solide, c’est-à-dire un mélange de cristaux non identiques dont chacun ne contient qu’un seul des deux énantiomères.
Application à la chromatographie en phase chirale :
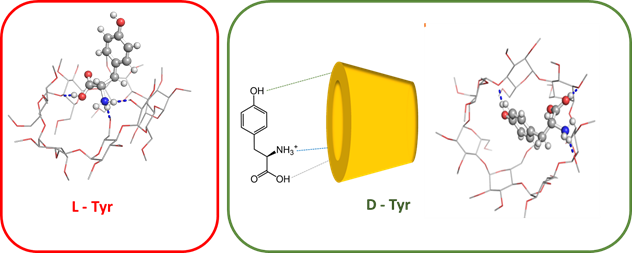
Certaines phases stationnaires chirales utilisées en chromatographie pour séparer les aminoacides sont construites sur des β-cyclodextrines. Le complexe formé entre la β-cyclodextrine et la D-tyrosine est plus stable que celui formé avec la L-tyrosine, parce la tyrosine s’intègre mieux dans la β-cyclodextrine grâce à la formation d’une liaison hydrogène supplémentaire. Ceci explique un temps de rétention supérieur en chromatographie.
Collaborations
Ces études ont impliqué des collaborations avec Martin Suhm (Université de Göttingen) et Masaaki Fujii/ Shun-ichi Ishiuchi (Tokyo Institute of Technology).
Publications
- Homochiral vs. heterochiral preference in chiral self-recognition of cyclic diols.
Dupont, J.; Hartwig, B.; Le Barbu-Debus, K.; Lepere, V.; Guillot, R.; Suhm, M.A.; Zehnacker, A. Physical Chemistry Chemical Physics 2024, 26 (14), 10610-10621. - Chiral discrimination between tyrosine and beta-cyclodextrin revealed by cryogenic ion trap infrared spectroscopy.
Hirata, K.; Mori, Y.; Ishiuchi, S. I.; Fujii, M.; Zehnacker, A. Physical Chemistry Chemical Physics 2020, 22, 24887. - Chirality effects in gas-phase spectroscopy and photophysics of molecular and ionic complexes:contribution of low and room temperature studies.
A. Zehnacker International Reviews in Physical Chemistry 33, (2014), 151.
- Etienne Rouquet – Thèse en cours
- Jennifer Dupont – Thèse Juillet 2022
- Feriel Ben Nasr – Thèse Juin 2019
- Ariel Francis Pérez Mellor – Thèse Octobre 2014
- Ananya Sen – Thèse Septembre 2012
- Ahmed Mahjoub – Thèse Juillet 2009
- Nathalie Seurre – Thèse Septembre 2004

Principe de la mesure de PECD résolu en conformère sur la base des méthodes de spectroscopie par REMPI
La sélection d’un conformère spécifique se fait via l’excitation résonnante du niveau fondamental S0 vers le premier niveau excité S1 propre à chaque conformère. Un deuxième photon à partir de l’état S1 permet ensuite l’ionisation du système et l’éjection de photoélectrons. Un détecteur de type cartographie d’imagerie de vitesse (VMI) rend possible la mesure de la distribution angulaire des photoélectrons. A partir de ces données, nous déduisons une mesure de PECD, signe de l’asymétrie de cette distribution pour une molécule chirale excitée et ionisée par une lumière polarisée circulairement.